印度 Temozolomide Temonat 100 替莫唑胺 替莫唑胺 泰道 蒂清 替莫唑胺胶囊
多形性胶质母细胞瘤,间变性星形细胞瘤
| 数量: | 库存 917 件 |
品牌名称 : Temonat -temozolomide
化学名称 : 替莫唑胺
形态 : 胶囊
制造商 : cipla
国际品牌 : 替莫唑胺 / temonat
规格: 100mg*5粒/盒
【适应症】
(1)新诊断的多形性胶质母细胞瘤,开始先与放疗联合治疗,随后作为辅助治疗。
(2)常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤。
【服用方法】
应空腹(进餐前至少壹小时)服用本品。服用本品前后可使用止吐药。如果服药后出现呕吐,当天不能服用第2剂。
百度百科您身边的百科全书
主要成分:替莫唑胺
化学名称: 3,4-二氢-3-甲基4-氧代咪唑并[5, 1-d]-不对称-四唑-8-酰胺
化学结构式:
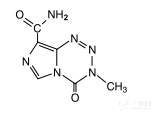
分子式: C6 H6N6O2
分子量:194.15
本品用于治疗:
新诊断的多形性胶质母细胞瘤,开始先与放疗联合治疗,随后作为维持治疗。
常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤。
新诊断的多形性胶质母细胞瘤的成人患者:
替莫唑胺先与局部放疗联合治疗(同步放化疗期),随后为最多6个周期的替莫唑胺(TMZ)单药治疗(维持治疗期)。
同步放化疗期
口服本品,每日剂量为75 mg/m2,共42天,同时接受局部放疗( 60 Gy分30次)。根据患者耐受程度可暂停用药,但无需降低剂量。同步放化疗期如果符合以下条件:绝对中性粒细胞计数≥1.5 x 109/L,血小板计数≥100x109/,普通毒性标准( CTC ) -非血液学毒性≤1级( 除脱发、恶心和呕吐外),本品可连续使用42天,最多49天。治疗期间每周应进行全血细胞计数。在同步放化疗期间应按表1所示血液学和非血液学毒性标准暂停或终止服用本品。
表1与放疗合并期间暂停或终止服用本品
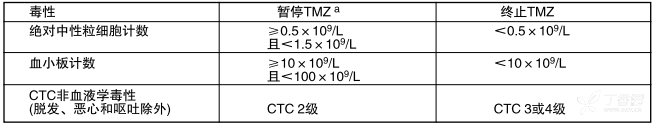
a:如果符合以下标准,可继续合并使用TMZ治疗:绝对中性粒细胞计数≥1.5x 109/儿,血小板计数≥100x109/L,CTC-非血液学毒性≤1级(脱发、恶心和呕吐除外)。
维持治疗期:
本品同步放化疗期结束后4周,进行6个周期的本品单药治疗。本品第1周期的剂量是150mg/m2/日,每日一次,共5天,然后停药23天。第2周期开始时,如果第1周期CTC的非血液学毒性≤2级(除脱发、恶心和呕吐外)、绝对中性粒细胞计数( ANC )≥1.5x 109/L和血小板计数≥100x 109/L,则剂量可增至200mg/m2/日。如果第2周期的剂量没有增加,在以后的周期中也不应增加剂量。除出现毒性外,以后各周期的剂量维持在每日200mg/m9。治疗期间应按表2和表3降低剂量。
治疗期间,第22天(首剂本品后21天)应进行全血细胞的计数。应按表3降低剂量或终止服用本品。
表2本品单药治疗的剂量水平
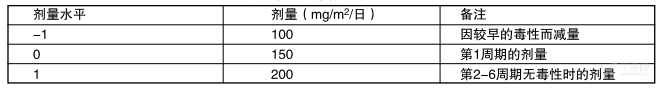
表3 单药治疗期间减量或终止用药
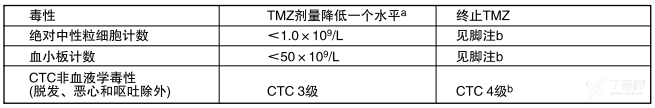
a: TMZ剂量水平见表2。
b:如果需要将TMZ降至<100 mg/m,2或如果降低剂量后重新出现同样的3级非血液学毒性( 脱发、恶心和呕吐除外),则应终止TMZ治疗。
常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤成人患者:
对于以前未接受过化疗患者,本品口服剂量是每日200mg/m2,共5天。每28天为一周期。对于以前曾接受过化疗患者,本品起始剂量是150mg/m2/日, 如果下个周期第一天的ANC≥1.5 x 109/L和血小板计数≥100x109/L,则第2周期的剂量增为200mg/m2/日。应根据ANC和血小板计数最低值调整本品的剂量。
调整剂量的实验室参数
必须符合以下实验室参数才能用药: ANC≥1.5 x109/L和血小板计数≥100x109/L。第22天(首剂后21天)或距离这一天的48小时内进行全血细胞计数,此后每周一次, 直至ANC≥1.5x109/L和血小板计数≥100 x109/L。如果任何一个周期内的ANC<1.0x 109/L或血小板计数<50x109/L,下个周期的剂量必须降低一个水平。剂量水平包括100mg/m2、150mg/m2和200mg/m2。推荐的最低剂量为100mg/m2。
在临床试验中,治疗继续到病变出现进展,最多为2年。但最佳的治疗持续时间未知。
特殊人群
儿童患者
本品仅用于3岁或3岁以上的复发或进展的恶性胶质瘤儿童患者。在这些儿童中使用该药的临床经验有限。尚未确立在3岁以下患儿使用该药的安全性和有效性。
在3岁或3岁以上的患儿中,推荐本品口服剂量是200mg/m2/日,共5天,每28天为一周期。对于以前曾接受过化疗患儿,本品起始剂量是150mg/m2/8,共5天;如果没有出现毒性,下个周期的剂量增至200mg/m2/日。
老年患者
根据一项在19-78岁患者中进行的群体药代动力学分析结果显示,TMZ的清除率不受年龄的影响。然而,老年患者(>70岁)中性粒细胞减少及血小板减少的风险似乎较大。
肝肾功能损害者:肝功能正常的病人与肝功能轻中度异常的病人药代动力学结果相似;严重肝功能异常( Child's Classlll)或肾功能异常的患者尚无服用替莫唑胺的资料。根据替莫唑胺胶囊药代动力学特征,对于严重肝肾功能不全的病人不必降低替莫唑胺用量,但应用时需倍加小心。
用法
应空腹(进餐前至少一小时)服用本品。服用本品前后可使用止吐药。如果服药后出现呕吐,当天不能服用第2剂。
不能打开或咀嚼本品, 应用一杯水整粒吞服。 如果胶囊有破损,应避免皮肤或粘膜与胶囊内粉状内容物接触。
新诊断的多形性胶质母细胞瘤
表4是新诊断为多形性胶质母细胞瘤患者在同步放化疗期和单药治疗期出现的不良事件(在临床试验中并未判断因果关系)。
表4 本品和放疗:同步放化疗期和单药治疗期间出现的事件
及常见(>1/10)、常见(>1/100,<1/10)、不常见(>1/1,000,<1/1,0)、CIOMSlll
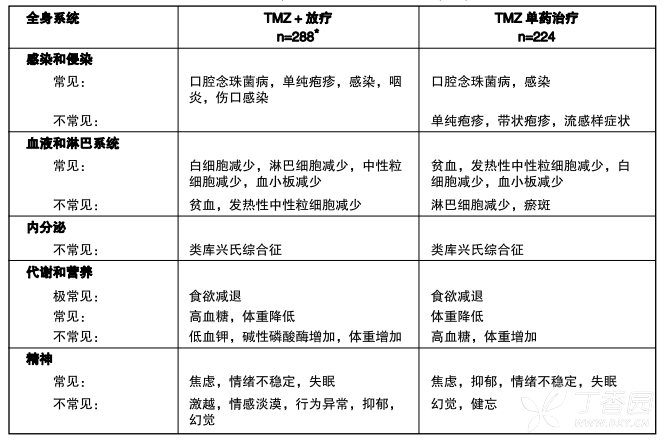
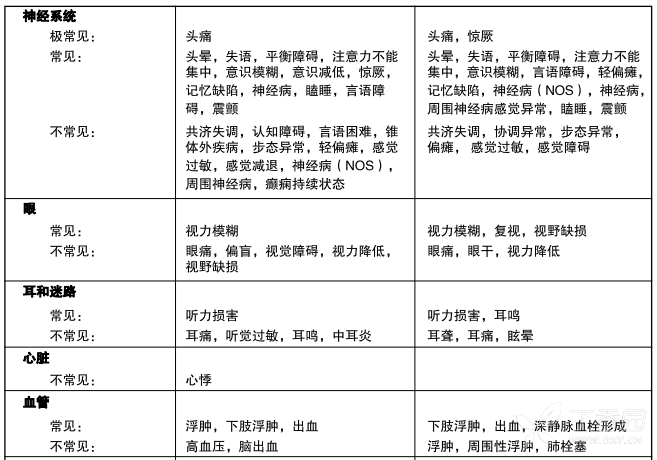
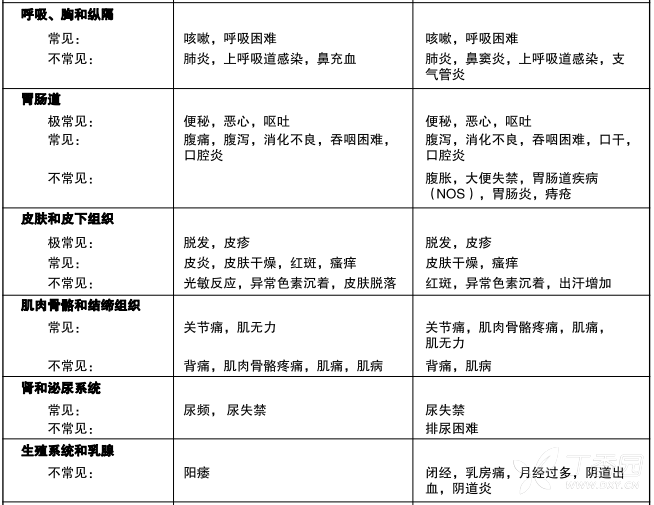
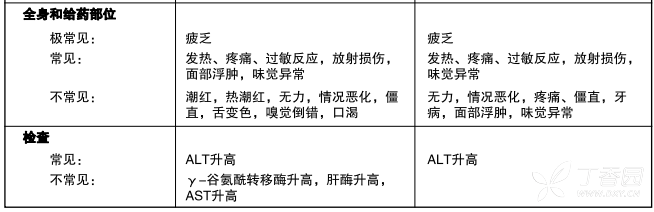
一例随机分配在放疗组的患者接受了本品+放疗
实验室结果:观察到骨髓抑制(中性粒细胞减少和血小板减少),这是大多数细胞毒药物(包括本品)的剂量限制性毒性。汇总本品同步放化疗期和单药治疗期中发生实验室异常和不良事件,有8%患者出现3级或4级中性粒细胞异常(包括中性粒细胞减少)事件;接受本品治疗患者中有14%出现3级或4级血小板异常(包括血小板减少)事件。
胶质瘤复发或进展的成人患者
临床试验中,最常发生的治疗相关不良反应是胃肠道反应,特别是恶心(43%)和呕吐(36%)。这些反应一般为1级或2级( 24小时内呕吐0-5次),具有自限性,或易于用标准止吐药控制。重度恶心和呕吐的发生率为4%。表5包括了替莫唑胺在复发或进展性恶性胶质瘤临床试验中和上市后报告的不良反应。
表5.复发或进展性恶性胶质瘤患者中的不良反应
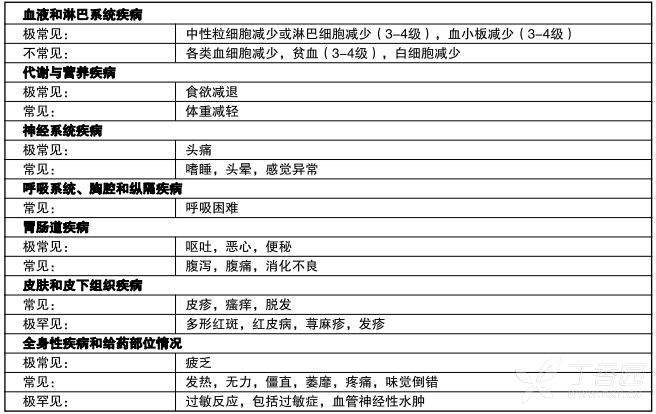
实验室结果:胶质瘤患者的3级或4级血小板减少和中性粒细胞减少的发生率分别为19%和17%。有8%和4%胶质瘤患者因此而住院和或停止本品治疗。骨髓抑制是可以预见的(一般在开始几个周期的第21-28天) ,通常在1-2周内迅速恢复。未发现有累积的骨髓抑制。曾有报道全血细胞减少、白细胞减少和贫血;淋巴细胞减少也很常见。
性别:对临床试验中不同性别进行的分析显示,达到中性粒细胞最低值的人数,女性101例,男性169例;血小板达到最低值人数,女性110例,男性174例。治疗的第一周期4级不良反应发生率女性高于男性,其中中性粒细胞减少( ANC<500cells/uL )女性12%,男性5%;血小板减少(<20,000 cells/L )女性9%,男性3%。在一组40例复发性神经胶质瘤受试者的数据中,治疗的第一周期的4级中性粒细胞减少发生率,女性与男性分别为8%和4%;而4级血小板减少的发生率则分别为8%和3%。在另一个有288例受试者参加的、新近诊断的多行性胶质母细胞瘤试验中,治疗第一周期的4级中性粒细胞减少发生率,女性与男性分别为3%和0%;4级血小板减少发生率则分别为1%和0%。
上市后经验:
本品上市期间,很少有机会性感染病例的报告,包括卡氏肺囊虫性肺炎以及巨细胞病毒的初次和再活动感染。乙型肝炎再活动的病例,包括-些引起致命性结果的病例,亦有报告。单纯疱疹脑炎病例,包括引起致命性结果的病例,亦有报告。极少报告过多形性红斑、中毒性表皮坏死、斯-约二氏综合症和变态反应(包括过敏反应)病例。
曾报告过间质性肺炎及肺纤维化的罕见病例。在接受本品治疗患者中报告过骨髓增生异常综合征(MDS)和继发的恶性疾病(包括髓细胞性白血病)的罕见病例。有导致再生障碍性贫血的全血细胞减少的报告,并且在一些病例出现了致命的后果。有见尿崩症的报道。曾报道过的肝脏毒性病例包括肝酶升高、高胆红素血症、胆汁淤积及肝炎。极少数使用替莫唑胺的病人出现肝脏损伤,包括致命的肝功能衰竭(详见[注意事项])。表6给出了上市后报告的严重不良事件。
表6.上市后报告的替莫唑胺不良事件总结

根据系统器官类别将事件分类。
频率为基于相关临床试验估算得出。
包括结果为死亡的病例。
在中国进行的临床研究中未出现非预期的不良事件,总体结果与国外报道的数据相似。
对替莫唑胺胶囊或达卡巴嗪(DTIC)过敏者禁用。
妊娠期禁用(见孕妇及哺乳期妇女用药)。
禁用于严重骨髓抑制的患者。
卡氏肺囊虫性肺炎:
在一项治疗时间延长到42天的小规模试验中,接受本品和放疗合并治疗的患者是卡氏肺囊虫性肺炎(PCP)的高危者。
因此无论淋巴细胞计数如何,对于接受42天(最多为49天)合并治疗的全部患者,需要预防卡氏肺囊虫性肺炎发生。如果出现淋巴细胞减少,则应继续预防至淋巴细胞恢复至≤1级。
在较长期的给药方案治疗期间,接受替莫唑胺治疗期间卡氏肺囊虫性肺炎发生率可能较高。不管何种治疗方案,都应密切观察替莫唑胺治疗的全部患者发生卡氏肺囊虫性肺炎的可能性,特别是接受类固醇治疗的患者。
在使用替莫唑胺的患者中曾报告致命的呼吸衰竭病例,尤其是与地塞米松或其他类固醇类联合治疗时。
肝毒性:
极少数使用替莫唑胺的患者出现肝脏损伤,包括致命的肝功能衰竭。在使用本品进行治疗前必须进行基线肝功能检查。如果基线肝功能异常,医生在开始替莫唑胺治疗前应进行风险获益评估,包括评估可能出现致命性肝功能衰竭的潜在风险。
对于进行42天治疗周期的患者需要在治疗周期中间进行肝功能检查。对于所有的患者,必须在每个治疗周期后进行肝功能的检查。对于有显著肝功能异常的患者,医生需要对是否继续治疗进行风险获益评估。另外,肝脏毒性可能在使用本品后数周或更长时间出现。
此外,报告了由于乙型肝炎病毒再活动引起肝炎而致死的一些病例。在治疗开始前应对患者进行乙型肝炎病毒感染筛查。在TEMODAL治疗期间和治疗结束后几个月内,监测既往存在乙型肝炎病毒感染的患者的乙型肝炎或HBV再活动的临床和实验室指征。对有证据表明活动性乙型肝炎感染的患者应停止治疗。
止吐治疗:
恶心和呕吐常与本品相关,服用本品前后可使用止吐药。指导原则为:
新诊断多形性胶质母细胞瘤的患者:
在开始接受替莫唑胺合并治疗前,建议采用止吐药预防,在单药治疗期间,极力建议采用止吐药预防。
神经胶质瘤复发或进展的患者:在以前治疗周期中出现过重度(3或4级)呕吐的患者需要止吐药治疗。
骨髓抑制:
男性患者:
乳糖:
对驾驶和操作机械能力的影响
替莫唑胺可导致疲劳和嗜睡,应避免对驾驶和操作机械能力的影响。
在一项单独的Ⅰ期研究中,同时服用雷尼替丁未改变替莫唑胺胶囊的吸收程度或对其活性代谢产物单甲基三氮烯咪唑甲酰胺(MTIC)的暴露。
根据Ⅱ期试验中的一项群体药代动力学分析,同时服用地塞米松、丙氯拉嗪、苯妥英、卡马西平、昂丹司琼、H2受体拮抗剂或苯巴比妥等,不影响替莫唑胺的清除。同时服用丙戊酸,替莫唑胺清除率出现轻度但有统计学意义的降低。
尚未研究考察替莫唑胺对其他药品代谢或消除的影响。然而,替莫唑胺不经肝脏代谢,且蛋白结合低,因此不太可能影响其他药品的药代动力学。
替莫唑胺胶囊与其他可导致骨髓抑制的药物联合应用时,骨髓抑制可能加重。
国外临床试验:
新诊断的多形性胶质母细胞瘤
573例患者随机接受替莫唑胺+局部放疗(n=287)或单一放疗(n=286)。替莫唑胺+局部放疗组患者在放疗首日开始服用替莫唑胺75mg/m2,每日一次,共42天( 最多为49天)。随后在放疗结束后4周开始替莫唑胺单药治疗: 28天-一个周期,每周期的第1-5天服药,每8150-200mg/m2,共6个周期。对照组患者仅接受放疗。放疗和与替莫唑胺联合治疗期间需要预防卡氏肺囊虫性肺炎(PCP) ,并持续到淋巴细胞减少恢复到≤1级。
随访期间,282例仅接受放疗的患者中有161例(57%)以及277例替莫唑胺+放疗的患者中有62例(22%)都再次接受了替莫唑胺的治疗。
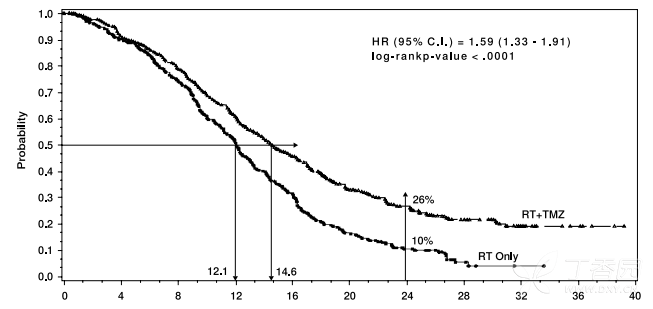
总生存的风险比(HR)为1.59 (95%CI为1.331.91),时序检验p<0.0001,有利于替莫唑胺组。替莫唑胺+放疗组2年生存率较对照组高( 26%对10% )。新诊断的多形性胶质母细胞瘤患者采用同步放化疗加替莫唑胺单药维持治疗后,总生存时间与单独放疗相比有明显提高,并有统计学意义。(图1 )
ItTT Population: OveraⅡ SurvivaⅠ
Time from randomization (months)
图1总生存时间的Kaplan-Meier曲线(意向性治疗人群, ITT )
常规治疗后复发或病变进展的恶性胶质瘤
手术或放疗后复发或病变进展的多形性胶质母细胞瘤患者( Karnofsky体力状态评分≥70)的临床有效性数据是来自两项临床试验。一项是在138例患者 (29%患者曾接受过化疗)中进行的无对照试验;另-项是在225例( 67%患者曾接受过以亚硝脲类为主的化疗)中进行的替莫唑胺与丙卡巴肼(甲基苄肼)的随机、对照试验。这二项试验的主要终点为无进展生存时间(PFS),以MRI扫描或神经系统症状恶化情况进行判断。在无对照的试验中,6个月的PFS为19%。中位PFS为2.1月,中位总生存时间为5.4月。MRI扫描的客观缓解率为8%。
随机、对照研究中,替莫唑胺组的6个月的无进展生存PFS明显高于丙卡巴肼组(21%对8%,卡方检验p=0.008 ),中位PFS分别为2.89月和1.88月(时序检验p=0.0063)。
替莫唑胺组和丙卡巴肼组的中位生存时间分别为7.34月和5.66月(时序检验p=0.33)。6个月时,替莫唑胺组患者存活的比例明显高于丙卡巴肼组,分别为60%和44%,卡方检验p=0.019。以前接受过化疗患者的Karnofsky体力状态有改善,可达到80或以上。
与体力状态恶化( KPS评分保持在60以上或至少降低30)的时间相同,神经系统症状恶化时间的数据,替莫唑}胺组也优于丙卡巴肼组。对于这些终点的中位进展时间,替莫唑胺组比丙卡巴肼组长0.7-2.1月(时序检验 p≤0.01-0.03)。
间变性星形细胞瘤
一项全球多中心的前瞻性、非随机的Ⅱ期试验,评价了口服替莫唑胺治疗首次复发间变性星形细胞瘤患者的安全性和有效性,46%患者的无进展生存时间达到6个月。中位无进展生存时间为5.4月。中位总生存时间为14.6月。
根据对ITT人群的集中评价,缓解率为35%,13例CR和43例PR。包括43例持续病变缓解,缓解率为61%。ITT人群中有6个月无事件生存时间达到44%,中位无事件生存时间为4.6月,与无进展生存时间相似。
对于适合组织学检查的人群,有效性结果也相似。患者达到放射学客观缓解或维持无进展状态时,能提高和保持其生活质量。
国内临床试验
2005年在中国进行的注册临床试验为多中心、开放、随机、阳性药平行对照的试验。比较替莫唑胺和司莫司汀治疗经常规治疗后复发或进展的胶质母细胞瘤或间变性星形细胞瘤的疗效和安全性的研究。
本研究共入选受试者144例,替莫唑胺组79例,司莫司汀组65例。替莫唑胺起始剂量150mg/m2/天(曾接受过化疗者)或200mg/m内容/天( 未接受过化疗者),连续5天口服给药,每28天为-治疗周期;司莫司汀起始剂量150mg/m2/天,1次顿服,每隔28天给药1次;两种药物治疗期均为2 ~6个月。
治疗至6月时,替莫唑胺组和对照组的无进展生存率分别为78.29%对55.08%,p=0.0384; 临床总缓解率(包括完全缓解和部分缓解)分别为45.83%对21.27%。
试验表明,替莫唑胺在治疗复发性胶质母细胞瘤(GBM)和间变性星形细胞瘤(AA)的疗效方面可能优于司莫司汀。
在小鼠、大鼠和犬进行了本品单剂量毒性研究。大鼠口服的LD50约为1900mg/m2,比小鼠高(约1000mg/m2)。对犬的最小致死剂量为600mg/m2。在单剂量研究中,毒性的临床体征和死亡一般出现都较迟,显示其对导致器官功能损害增生迅速的组织具有迟发性毒性作用;毒性作用符合烷化剂的预期毒性。
口服本品后被迅速吸收,并很快排泄到尿中。人治疗剂量的暴露程度与大鼠和犬的相似。业已进行了3个周期和6个周期的大鼠和犬的毒性研究,一个周期为给药5天,停药23天。在多周期研究中,主要毒性靶器官是骨髓、淋巴网状系统,睾丸和胃肠道。
本品对大鼠和犬的毒性比对人较大。人对治疗剂量(200mg/m2)能很好耐受,但该剂量接近大鼠和犬多剂量的最低致死剂量。
白细胞和血小板与剂量相关的减少是大鼠和犬的敏感指标。在治疗间期,大多数血液学和生化指标以及和组织病理改变能明显恢复。
在6个周期大鼠研究中考察的瘤谱包括乳腺癌、皮肤角化棘皮瘤、基底细胞腺瘤和各种间质瘤。
犬研究中未考察肿瘤或癌前变化。考虑到本品是烷化剂MTIC的前体药物,预期具有致瘤的作用,这在其他烷化剂(包括产生MTIC的)中已观察到。本品对大鼠的致瘤作用似乎是物种特异的,与其他化疗药物无明显差异。
本品Ames/沙门氏菌和HPBL试验中显示有致突变作用;并在人外周淋巴细胞测定中能引起染色体畸变。