孟加拉Cabozantinib 卡博替尼 20mg
肾癌,甲状腺癌,肝癌,软组织肉瘤,非小细胞肺癌,前列腺癌,乳腺癌,卵巢癌,肠癌
| 数量: | 库存 121 件 |
产品名称 : Cabozanix
通用名称 : 卡博替尼
剂型 : 胶囊
包装 : 90 片 或 30 片
规格 : 20 mg 或 80 mg
产地 : 孟加拉国
产品介绍:
卡博替尼(Cabozantinib)是壹个多靶点的广谱抗癌药,能抑制的靶点包括:MET、VEGFR1/2/3、ROS1、RET、AXL、NTRK、KIT等至少9个。
目前,卡博替尼已经在肾癌、甲状腺癌、肝癌、软组织肉瘤、非小细胞肺癌、前列腺癌、乳腺癌、卵巢癌、肠癌等多种实体瘤中,证实了较好的治疗效果,对于骨转移的控制效果尤其突出。因其对于多种癌症的广泛有效性,卡博替尼被称为靶向药中的“万金油”,具有广谱抗癌能力。
治疗肾细胞癌:卡博替尼的有效率是索坦的数倍(46% vs 18%),生存期明显延长(30.3个月 vs 21.8个月)。两药的副作用很接近,不良反应发生率,67% vs 68%。主要的副作用是:腹泻、乏力、高血压、手足综合征等。目前,卡博替尼已经成为晚期肾癌的首选治疗的壹线药物。
治疗肝细胞癌:接受卡博替尼治疗的晚期肝癌患者生存期明显延长,死亡风险下降了37%。客观有效率大约为5%。目前,卡博替尼已经和瑞戈非尼、PD-1抗体等药物壹道,成为晚期肝癌治疗药物之壹。
治疗肺癌:在非小细胞肺癌患者中,2%左右的患者携带RET基因重排。这类患者可以接受卡博替尼治疗。2016年,权威医学杂志《柳叶刀-肿瘤学》发表了卡博替尼用于RET重排的肺癌患者的临床试验数据:26位患者,有效率是28%,肿瘤控制率接近100%。
此外,壹线治疗失败的EGFR野生型的肺癌患者,使用卡博替尼联合特罗凯比单用卡博替尼或者单用特罗凯,生存期明显延长,联合用药组的生存期是13.3个月,单用卡博替尼组是9.2个月,单用特罗凯是5.1个月。
治疗甲状腺癌:对于携带RET突变的甲状腺癌患者,卡博替尼明显延长了总生存期,从18.9个月延长到了44.3个月,翻了壹倍都多。总人群中,总生存期也从21.1个月,延长到了26.6个月。
卡博替尼作用的分子靶点很多,部分靶点参与了骨转移的形成,具有很好的控制实体瘤骨转移的能力,已被广泛用于肾细胞癌骨转移和前列腺癌骨转移的治疗。
卡博替尼可以通过清除肿瘤周围助纣为虐的“骨髓来源的免疫抑制细胞”(MDSC细胞)等方式,增加患者对PD-1抗体等免疫治疗的疗效。因此,不少研究将卡博替尼选为PD-1抗体的“黄金搭档”,进行联合治疗并取得了良好的治疗效果。
碧康制药生产的Cabozanix是卡布替尼在全球的首仿药,也是迄今为止唯壹获得政府监管机构批准合法生产的仿制药。
碧康制药由欧洲财团参与投资,是南亚地区唯壹执行欧盟技术规范,并且在孟加拉国两大证券交易所主板上市的大型制药企业,产品符合欧洲药典和美国药典标准。
相比其他来源不清晰的所谓同壹种仿制药,即使其主要成份含量与碧康产品相接近,但由于不具备严格规范的GMP标准生产场所和政府部门的严格监管,其产品中影响药物吸收率的溶出度和生物利用度也与碧康产品具有很大差异。
为保证用药安全,敬请谨慎选择!
适应症:
卡博替尼的适应症广泛,主要包括:
(1)适用于曾接受抗血管生成治疗的晚期肾癌;
(2)适用于无法采用手术摘除的髓样甲状腺癌;
(3)适用于使用多吉美耐药后的肝癌患者
(4)适用于发生骨转移的晚期前列腺癌患者
用法与用量:
(1)推荐剂量为每日140mg(1粒80mg胶囊和3粒20mg胶囊);
(2)不可与食物壹起食用;
(3)服用药物前和至少壹小时后共至少2小时不要进食;
(4)对不良反应,可考虑减低剂量或治疗中断。
常见副作用:
腹泻、恶心、呕吐、便秘、口腔溃疡、鼻出血、食欲下降等。
百度百科您身边的百科全书
CABOMETYX是卡赞替尼[cabozantinib]的(S)-苹果酸盐,一个激酶抑制剂。
卡赞替尼(S)-苹果酸盐是白色至米白色固体实际上不溶于水性介质。
CABOMETYX(卡赞替尼)片以薄膜包衣片含20mg,40mg,或60mg卡赞替尼供应,分别是等同于25mg,51mg,或76 mg的卡赞替尼(S)-苹果酸盐。
CABOMETYX还含以下无活性成分:微晶纤维素,无水乳糖,羟丙基纤维素,羧甲基纤维素钠,胶体二氧化硅,和硬脂酸镁。
膜包衣含羧丙基纤维素,二氧化钛,三乙酰甘油酯,和氧化铁黄。
不要用卡赞替尼胶囊替代CABOMETYX片。
CABOMETYX推荐的每天剂量是60 mg,不要与食物给予CABOMETYX。指导患者服用CABOMETYX前和至少1小时后共至少2小时不要进食。继续治疗直至患者再也不经历临床获益或经受不可接受毒性。
整吞CABOMETYX片。不要压碎CABOMETYX片。
下一剂量12小时内不要服用缺失剂量。
CABOMETYX 治疗期间不要摄取食物(如,柚子,柚子汁)或营养补充物已知抑制细胞色素P450。
1. 对正在进行手术患者
计划安排的手术前至少28天停止治疗用CABOMETYX,包括牙科手术。
2. 对不良反应
对美国国家癌症研究所不良事件常用名词[NCI CTCAE] 4级不良反应,和对3级或不能耐受的2级不良反应,当不能用一个剂量减低或支持医护处理时不给CABOMETYX。
在一个不良反应解决/改善时(即,返回至基线或解决至1级),减低剂量如下:
如以前地接受60 mg每天剂量,在40 mg每天恢复治疗
如以前地接受40 mg每天剂量,在20 mg每天恢复治疗
如以前地接受20 mg每天剂量,如耐受在20 mg恢复,否则,终止CABOMETYX
因以下任何情况永久地终止CABOMETYX:
发生不能处理的瘘管或GI穿孔
严重出血
动脉血栓栓塞事件(如,心肌梗死,脑梗塞)
高血压危象或严重高血压尽管最佳医学处理
肾病综合征
可逆性后部白质脑病综合征
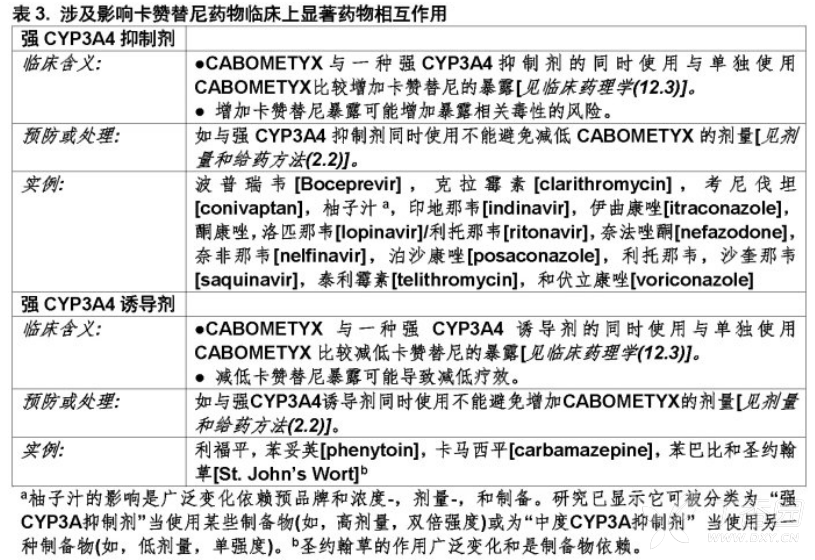
3. 在当前地服用一个强CYP3A4抑制剂患者
减低每天CABOMETYX剂量20 mg(例如,从60 mg至40 mg每天或从40 mg至20 mg每天)。终止强抑制剂后2至3天恢复CYP3A4抑制剂开始前使用剂量【见药物相互作用,临床药理学】。
4. 在当前地服用一个强CYP3A4诱导剂患者
如耐受时增加每天CABOMETYX剂量20 mg(例如,从60 mg至80 mg每天或从40 mg至60 mg每天)。强诱导剂终止2至3天恢复CYP3A4诱导剂开始前使用剂量。CABOMETYX的每天剂量不应超过80 mg【见药物相互作用,临床药理学】。
5. 在有肝受损患者
在有轻度或中度肝受损患者中减低CABOMETYX的开始剂量至40 mg每天1次。建议在有严重肝受损患者不使用CABOMETYX【见特殊人群中使用】,临床药理学】。
出血【见注意事项(1.)】
GI穿孔和瘘管【见注意事项(2.)】
血栓性事件【见注意事项(3.)】
高血压和高血压危象【见注意事项(4.)】
腹泻【见注意事项(5.)】
掌跖红感觉迟钝综合征【见注意事项(6.)】
可逆性后部白质脑病综合征【见注意事项】
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
的安全性CABOMETYX was evaluated in 研究1,a 随机化,开放 trial in which 331患者有晚期肾细胞癌接受60 mg CABOMETYX和322患者接受10mg依维莫司给予每天直至疾病进展或不可接受毒性。
两臂患者都在研究者判断有疾病进展能继续治疗见临床研究(14)]。对接受CABOMETYX患者治疗的中位时间为7.6个月(范围0.3–20.5)和对接受依维莫司患者为4.4个月(范围0.21–18.9)。
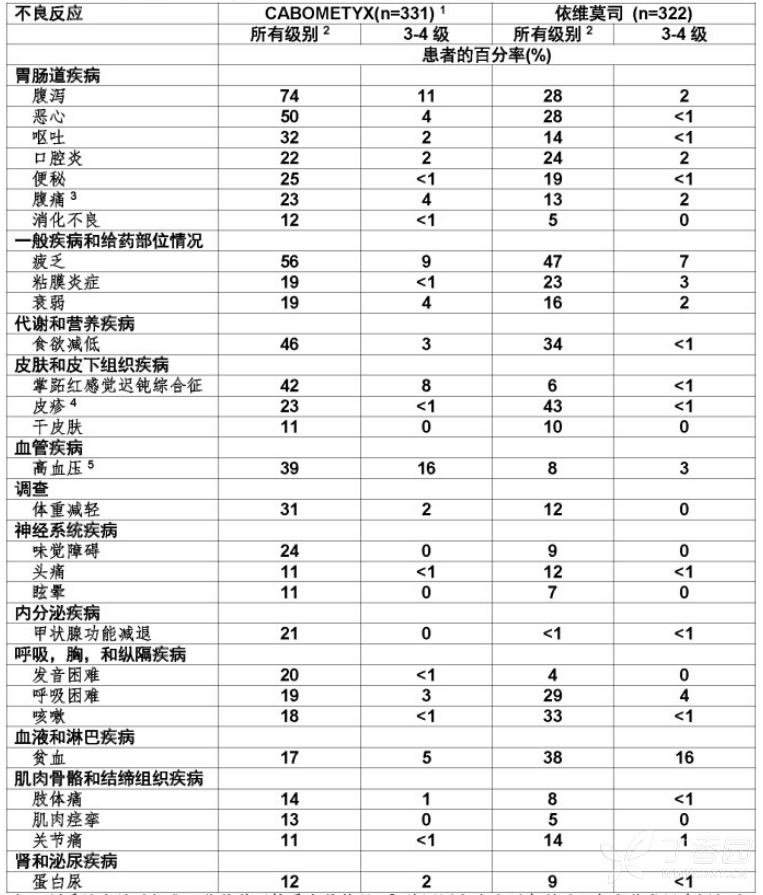
在≥25%的CABOMETYX-治疗患者发生不良反应包括,以降序频数:腹泻,疲乏,恶心,食欲减退,掌跖红感觉迟钝综合征(PPES),高血压,呕吐,体重减低,和便秘。
在≥5%患者发生的3-4级不良反应和实验室异常为高血压,腹泻,疲乏,掌跖红感觉迟钝综合征,低钠血症,低磷血症,低镁血症,淋巴细胞减低,贫血,低钾血症,和GGT增加。
在60%患者接受CABOMETYX剂量被减低和在24%患者接受依维莫司。
20%患者接受20mg CABOMETYX作为他们的最低剂量。用CABOMETYX治疗患者最频繁不良反应导致剂量减低为:腹泻,PPES,疲乏,和高血压。
在70%患者接受CABOMETYX不良反应导致研究治疗正在停止和接受依维莫司患者为59%。接受CABOMETYX患者10%中不良反应导致研究治疗终止和在接受依维莫司患者中为10%。
用CABOMETYX治疗患者中最频繁不良反应导致永久终止为食欲减退(2%)和疲乏(1%)。
表1:接受CABOMETYX患者发生≥10%不良反应
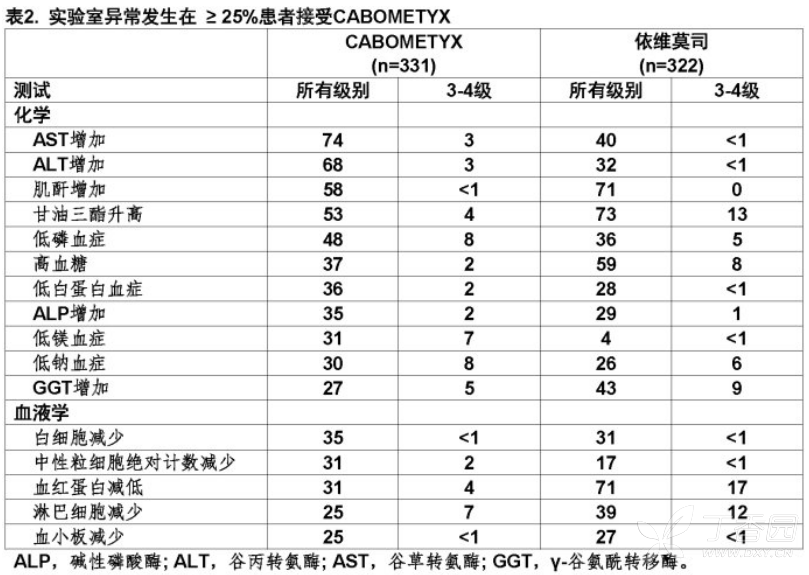
用CABOMETYX治疗患者其他临床上重要不良反应(所有级别)被报道<10%是包括:伤口并发症(2%),抽搐(<1%),胰腺炎(<1%),颚骨坏死(<1%),和淤胆型肝炎(<1%)。
1. 出血
用CABOMETYX发生严重出血。在CABOMETYX-治疗患者≥ 3级出血事件发生率为2.1%而在依维莫司[everolimus]-治疗患者1.6%。
在卡赞替尼临床计划还发生致命性出血。
不要给予CABOMETYX有严重出血或处于严重出血风险患者。
2. GI穿孔和瘘管
在一项随机化肾细胞癌研究中,CABOMETYX-治疗患者报道瘘管1.2%(包括0.6%肛门瘘管) 而依维莫司-治疗患者为0%。
CABOMETYX-治疗患者报道胃肠道(GI)穿孔0.9%而依维莫司-治疗患者0.6%。卡赞替尼临床计划中发生致命性穿孔。
监视患者瘘管和穿孔症状。经受一个瘘管不能适当地处理或GI穿孔患者终止CABOMETYX。
3. 血栓性事件
CABOMETYX治疗导致血栓性事件发生率增加。CABOMETYX-治疗患者报道静脉血栓栓塞7.3%而依维莫司-治疗患者为2.5%。CABOMETYX-治疗患者发生肺栓塞3.9%而依维莫司-治疗患者为0.3%。CABOMETYX-治疗患者报道动脉血栓栓塞事件0.9%而依维莫司-治疗患者为 0.3%。在卡赞替尼临床计划中发生致命性血栓性事件。
在发生一个急性心肌梗死或任何其他动脉血栓栓塞合并症患者终止CABOMETYX。
4. 高血压和高血压危象
5. 腹泻
6. 掌跖红感觉迟钝综合征
7. 可逆性后部白质脑病综合征
8. 胚胎-胎儿毒性
根据来自动物研究数据和其作用机制,当给予妊娠妇女CABOMETYX可能致胎儿危害。卡赞替尼在器官形成期给予至妊娠动物在暴露低于临床上推荐剂量时暴露时导致胚胎胎儿致死,和在大鼠增加骨骼变异发生率和在兔中内脏变异和畸形。忠告妊娠妇女对胎儿潜在风险。
忠告生殖潜能女性用CABOMETYX治疗期间和末次剂量后共4个月使用有效避孕 【见特殊人群中使用,和临床药理学】。
推荐剂量:60 mg口服,每天1次。
指导患者服用CABOMETYX前和后至少1小时不要吃共至少2小时。
不要用卡赞替尼胶囊替代CABOMETYX片。
CYP3A4抑制作用对卡赞替尼
CYP3A4诱导作用对卡赞替尼
卡赞替尼对CYP2C8底物
胃pH修饰药物对卡赞替尼
质子泵抑制剂(PPI)埃索美拉唑esomeprazole与一个单剂量100 mg卡赞替尼至健康志愿者。共同给药后未观察到对血浆卡赞替尼暴露(AUC)临床上显著影响。
CYP3A4的抑制作用减低氧化代谢物的形成> 80%。CYP2C9的抑制作用对卡赞替尼代谢物形成有小影响(即,一个<20%减低)。CYP1A2,CYP2A6,CYP2B6,CYP2C8,CYP2C19,CYP2D6和CYP2E1的抑制作用对卡赞替尼代谢物形成无影响。
虽然卡赞替尼是CYP2C8在体外的一个抑制剂,这个潜在相互作用的临床研究结论当前使用不导致对CYP2C8底物暴露临床效果影响。给予这个发现在临床研究中没有评价,在体外被卡赞替尼影响通路其他较低敏感底物(即,CYP2C9,CYP2C19,和CYP3A4)因为尽管不能除外临床相关暴露影响,它可能无影响。
在体外卡赞替尼不抑制CYP1A2和CYP2D6同工酶。
卡赞替尼是CYP1A1 mRNA的一种诱导剂;但是,不知道这个发现的临床相关性。卡赞替尼 不诱导CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19或CYP3A4。
药物转运系统
卡赞替尼是一种P-gp转运活性的抑制剂,但不是底物,和有增加P-gp共同给予底物血浆浓度潜能。不知道这个发现的临床相关性。
卡赞替尼是MRP2在体外一种底物和MRP2抑制剂有增加卡赞替尼血浆浓度潜能。不知道这个发现的临床相关性。
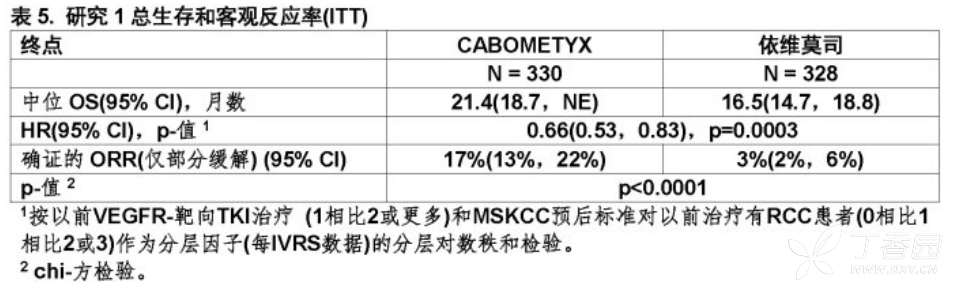
研究1是一项在有晚期曽接受至少1个以前抗血管生成治疗RCC患者中进行CABOMETYX相比依维莫司随机化(1:1),开放,多中心研究。
患者已有一个Karnofsky性能评分(KPS)≥70%。患者按以前VEGFR酪氨酸激酶抑制剂数和Sloan Kettering癌症中心纪念馆(MSKCC)风险组分层。
患者(N=658)被随机化接受CABOMETYX(N=330)口服给药在60mg每天或依维莫司(N=328)口服给予在10mg每天。患者的多数为男性(75%),有中位年龄62岁。69%仅接受一个以前抗-血管生成治疗。
患者按MSKCC风险组分布为46%良好(0风险因子),42%中间(1风险因子),和13%差(2或3风险因子)。54%患者有3或更多器官有转移疾病,包括肺(63%),淋巴结(62%),肝(29%),和骨(22%)。
主要疗效结局测量为被一个盲态独立放射学评审委员会评估的首次375例随机化受试者中无进展生存(PFS)。其他疗效终点为在意向治疗人群(ITT)中客观反应率(ORR)和总体生存(OS)。
对头12个月每8周进行肿瘤评估,然后其后每12周。患者接受治疗直至疾病进展或经受不能接受的毒性。在研究者的判断下两臂患者有疾病进展均可继续治疗。
CABOMETYX与依维莫司比较在PFS,OS,和ORR都显示统计显著改善(图1和2和表4和5)。
图1:在研究1无进展生存(首次375例随机化) 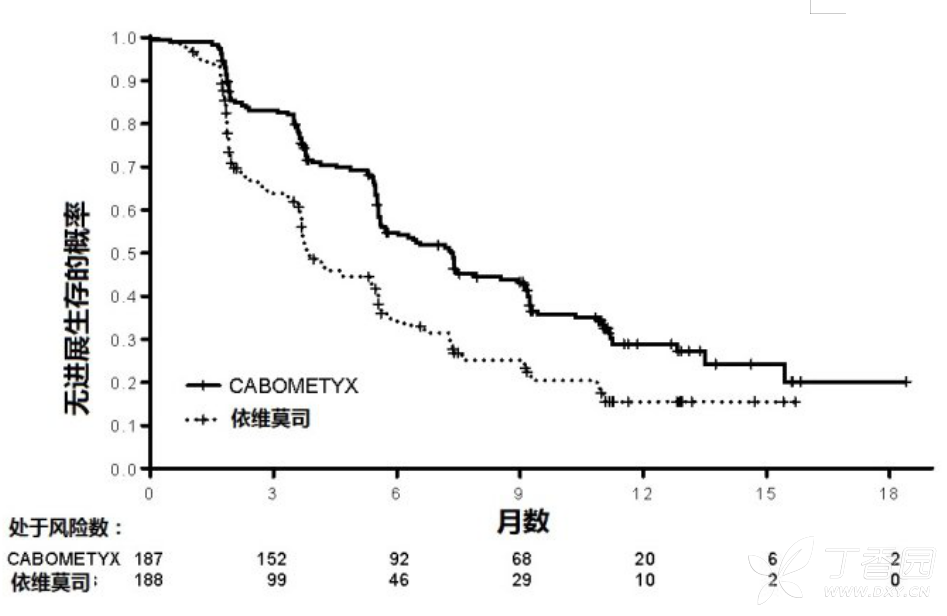

图2:在研究1中总生存(ITT)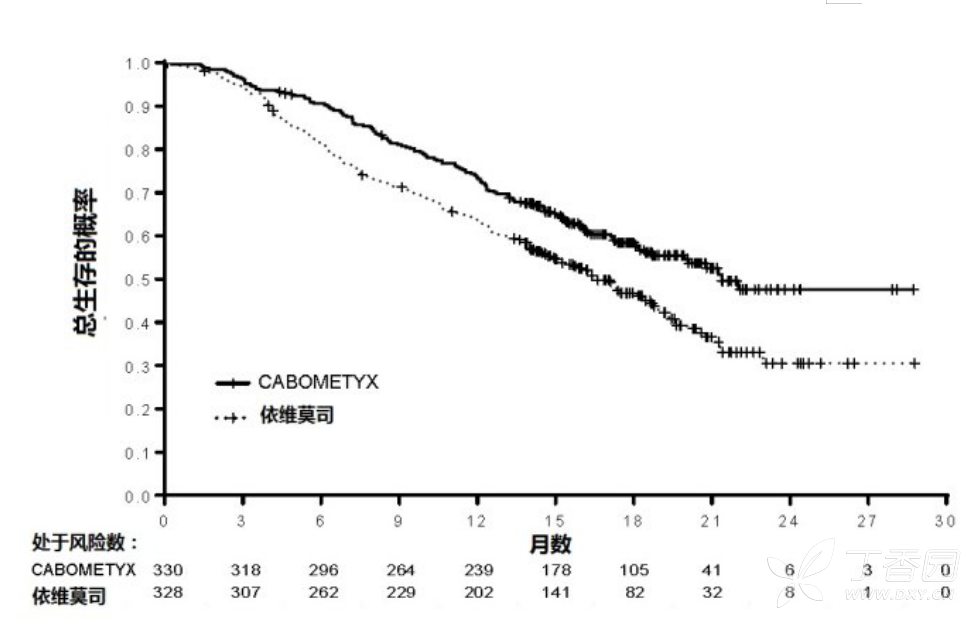
癌发生,突变发生,生育力受损
在rasH2转基因小鼠一项26-周致癌性研究卡赞替尼没有致癌性。在体外细菌回复突变(Ames)试验卡赞替尼没有致突变性和在体外细胞遗传试验利用人淋巴细胞或在体内小鼠微核试验都没有致染色体断裂性。
根据非临床发现,用CABOMETYX治疗雄性和雌性生育力可能受损。在一项生育力研究其中卡赞替尼被给予雄性大鼠在剂量1,2.5,和5mg/kg/day,在剂量等于或大于2.5mg/kg/day(在推荐剂量人AUC约13-倍),雄性生育力被显著地受损有精子计数减低和生育器官重量减低。
在雌性中,在剂量等于或大于1mg/kg/day(在推荐剂量人AUC的5-倍)生育力显著地减低有活胚胎数显著减低和围产期植入丢失显著增加。
在一般毒理学研究对生殖道组织影响的观察注意到在专门生育力研究效应的支持和包括在一项6-个月重复剂量研究在血浆暴露(AUC)在人推荐剂量期望暴露的约0.5-倍(雄性)和<0.1-倍(雌性)在雄性和雌性犬精子过少和缺乏黄体。
此外,雌性大鼠给予5mg/kg/day共14天(在人推荐剂量人AUC约9-倍f)表现出卵巢坏死。
卡赞替尼(S)-苹果酸盐化学上被描述为N-(4-(6,7-dimethoxyquinolin-4-yloxy)phenyl)-N’-(4- fluorophenyl)cyclopropane-1,1-dicarboxamide,(2S)-hydroxybutanedioate。
卡赞替尼(S)-苹果酸盐化学结构为:
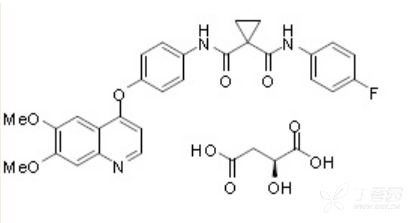
分子式为:C28H24FN3O5·C4H6O5
分子量为:635.6 道尔顿作为苹果酸盐